抄読会へのご参加、ありがとうございました
2025年2月抄読会
今月は、非常に内容の濃い充実した抄読会でした。
ご発表いただいた先生、大変ありがとうございました。
抄読会の内容を振り返らせていただきます。
1)群馬大学医学部附属病院 前野 敏孝先生 ビレーズトリ®️ vs テリルジー®️ in patients with COPD
「慢性閉塞性肺疾患に対する単一吸入器による3剤併用療法の有効性と安全性の比較:新規ユーザーコホート研究」
Feldman WB, et al. Comparative effectiveness and safety of single inhaler triple therapies for chronic obstructive pulmonary disease: new user cohort study. BMJ. 2024; 30;387:e080409.
COPD患者の一部にはトリプル吸入器療法が推奨されており、budesonide-glycopyrrolate-formoterol(ビレーズトリ®️) 、fluticasone-umeclidinium-vilanterol(テリルジー®️)が利用可能です。しかし、1日2回定量噴霧式吸入器MDIであるビレーズトリ®️と、1日1回ドライパウダー吸入器DPIであるテリルジー®️の比較有効性および安全性は不明です。
そこで本研究では、87751人の患者ビレーズトリ®️の新規使用者67356人とテリルジー®️の新規使用者20395人がコホートに含まれ、そこから一次解析のために20388組のマッチングペアが同定されました。
主要アウトカムは、最初の中等度または重度のCOPD増悪(有効性)と最初の肺炎による入院(安全性)でした。
マッチされたコホートでは、15229人年の追跡期間中に7729件の中等度または重度の増悪が認められ、1000人年当たりの粗発生率は507.5件でした。
ビレーズトリ®️群では、テリルジー®️投与群と比較して、中等度または重度のCOPD初回増悪の危険性が9%増加し(HR 1.09(95%CI 1.04〜1.14))、肺炎による初回の入院の危険性は同等でした。
また、患者が経験する疾患の負担をより十分に反映する年間累積増悪を分析した場合にも、同様の結果が観察されました。
ビレーズトリ®️の使用に伴うリスクは、サブグループ分析で重度COPD増悪を個別に分析した場合により顕著となり、ビレーズトリ®️を投与された患者は、 テリルジー®️を投与された患者と比較して、最初の重度COPD増悪の危険性が29%高くなっていました。
非継続率が高く、追跡期間が短かったことは、COPD患者が推奨された治療を中止することが多いという日常臨床の現実を反映しています。最適ではない吸気力が認められる患者は、中等度または重度のCOPD増悪を経験するリスクが約1.8倍となります。 これらの結果とシングルインヘラー・トリプル療法(SITT)の気候変動への影響を踏まえ、薬価基準や治療ガイドラインを策定する医療システムは、COPD患者に対してビレーズトリ®️よりもビレーズトリ®️の使用を増やすことを検討する方が良い治療選択肢と思われました。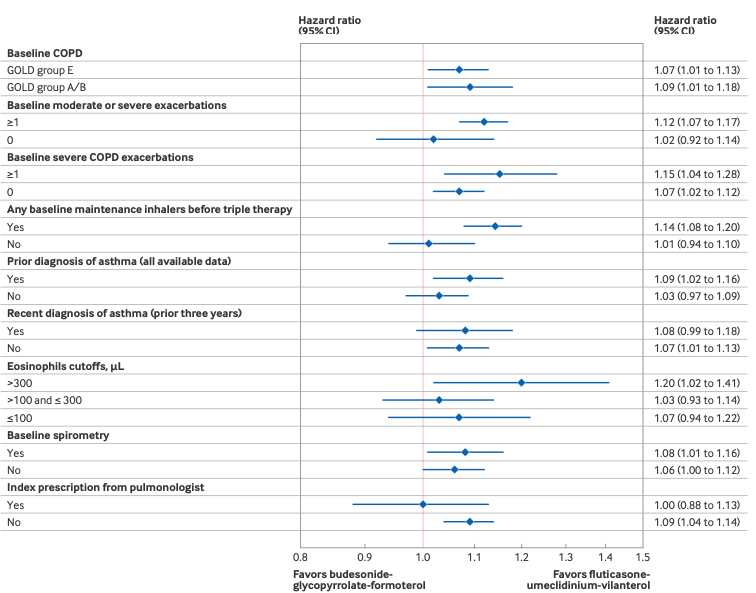
2)群馬大学医学部附属病院 三浦 陽介先生
「EGFR-TKI関連間質性肺疾患に対するPPIの影響について」
Wang H, et al. PPIs effect in EGFR-TKI-associated interstitial lung diseases in patients with non-small cell lung cancer. BMC Cancer. 2025 Feb 14;25(1):263.
EGFR-TKIによる間質性肺疾患の発症頻度は0.3~4.3%(海外)で、オシメルチニブではさらにその発症頻度が高まると言われています。そのリスク因子として併用薬があり(ニボルマブなど)、がん患者の16~21%でPPIが投与されています。胃酸分泌抑制が肺感染症のリスクを上げ、肺感染症がILDのトリガーになりうると言われています。そのため、PPI併用がILDリスクを上げることが理論上予想されるが、この点を検討した研究はこれまでありません。
そこで本研究では、2016年~2023年にFAERSデータベースに登録された87504名の非小細胞肺癌患者を対象に、肺がん治療薬、PPI使用有無、ILD発症との関係を検討しました。
EGFR-TKIと特定の種類のPPIとの併用はEGFR-TKI単剤よりもILD発症頻度が上昇していました(ROR 0.74-3.56)。またオシメルチニブとPPIの併用ではOR3.24と他のTKIとPPIの組み合わせの中で最もILDリスクが高い結果でした。
本研究結果より、EGFR-TKIによるILDに与える影響はPPI毎に異なるかもしれず、EGFR-TKIとPPIを併用するときにはILDに十分注意してモニタリングしていくことが肝要と考えられました。
中でも、オシメルチニブはランソプラゾールやエソメプラゾールとの併用でILDリスク上昇しており、他のTKIではこの現象がみられませんでした。
ランソプラゾール、TKIはともにCYP3A4で代謝、他のPPIはCYP2C19などで代謝されます。
また、他の薬剤と違い、オシメルチニブの吸収が胃内pHの影響を受けないことが関係しているかもしれません。
主なlimitationは、
① 自発的な報告データに頼っているためデータが不完全・不正確
② ILD発症に関わる重要な因子(過去の治療歴、併存疾患、併用薬剤など)が欠損
③ 医療従事者以外からの報告も含まれていること
が挙げられました。
今回の検討結果から、オシメルチニブとPPIを併用するなら、オメプラゾールやラベプラゾールの方がより安全な可能性が示唆されました。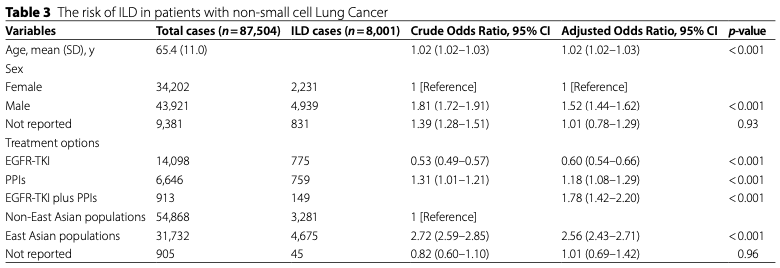
3)渋川医療センター 村田 圭祐先生
「気管支断端瘻に対する気管支鏡的介入」
Lingli Jin, et al. Bronchoscopic interventions for bronchopleural fistulas. Ther Adv Respir Dis 2023, Vol. 17: 1–10
気管支断端瘻に対する外科的治療は、大網や遊離筋を皮弁とした外科的充填術が標準的です。開窓術・胸郭形成術を要するため、長期間の創処置により日常生活や社会活動が大きく制限されてしまいます。
そのため本論文は、気管支断端瘻に対し侵襲の大きい外科的治療を回避できないか、という課題に対する、気管支断端瘻への気管支鏡によるインターベンションの総説です。
インターベンションの前に、断端瘻を同定する手段は以下の通りです。
. バルーン閉塞による局在同定
・遠位や末梢にある気管支瘻を発見するために、気管支鏡による連続的なバルーン閉塞が推奨されます。標的気管支内でバルーンを拡張させドレーンバッグ内のair leakが消失したことを確認します。
・メチレンブルーによる局在同定
メチレンブルーを標的気管支開口部から注入し、胸腔ドレーンから青色染料液の流出を確認します。気管支鏡で観察下に胸腔ドレーンからメチレンブルーを逆行性に注入し、視野に青色染料液を確認する方法も有効です。ただし、染料はもっとも抵抗の少ない経路を通るため、多発性の瘻孔を見逃す可能性があり、患者に手術が必要な場合、色素沈着により縦隔と胸部組織の識別能が損なわれてしまいます。
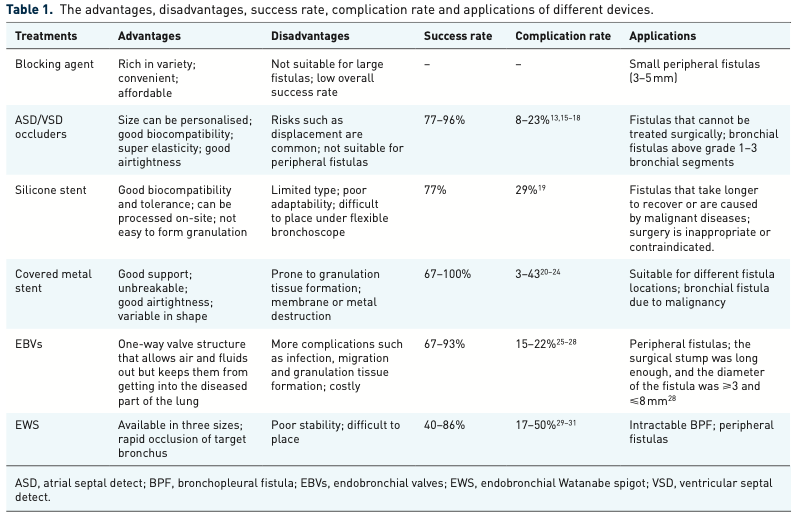
気管支断端瘻に対する気管支鏡的治療手段は以下のとおりです。
・塞栓物質
・ASD/VSD用パッチ
・シリコンステント
・カバー型金属ステント
・EBV
・EWS
また、瘻孔が遠位で径が小さい(<6mm)場合、気管支鏡手技による瘻孔閉鎖の成功率は71~92%と高くなります。
・塞栓物質:主に肉芽組織の形成を誘導または刺激することで作用し、細胞増殖、瘢痕化、最終的な瘻孔閉鎖へと導きます。エタノール、フィブリン接着剤、アルブミン-グルタルアルデヒド組織接着剤、酸化再生セルロース、エチル-2-シアノアクリレート、硝酸銀など瘻孔の大きさや患者の基礎疾患によって選択します。
メリット:製剤の選択肢が多い、標的気管支への注入が簡便、安価
デメリット:大きな瘻孔に対しては適さない、全体的に成功率が低い
ASD/VSD用パッチ:カテーテルを介して瘻孔部位に送り、瘻孔で自己拡張し両側の円板で瘻孔を閉鎖します。
メリット:・瘻孔のサイズに合わせて8~40mmサイズまで選択可能で、生体適合性が良好、弾性に富み気密性にもすぐれています
デメリット:逸脱がまれではなく、末梢側の瘻孔には適さず、適応外使用となります。
シリコンステント:気管上~中部、主気管支に対してはストレートステント、気管下部、気管分岐部、副気管支に対してはY字ステント。種類は限られますが、現場で手作業で切断や変形などの修正が可能です。(金属ステントと比較して)耐久性にすぐれ抜去が容易で低コストです。
メリット:現場での加工修正が可能、生体適合性が良好で忍容性も高く、肉芽を形成しにくいです。
デメリット:ステントの種類が限られ、細かい融通が効きにくく、硬性気管支鏡での留置が必要となります
カバー型金属ステント
メリット:・支持性が高く破断しにくく、気密性が高く、形状が柔軟です。
デメリット:肉芽組織の形成をおこしやすく、カバーまたは金属の破損があり得ます
EBV(Endobronchial Valve)
メリット:・気管支断端瘻による長期気胸例で有用で、(全身麻酔または局所麻酔下で)軟性気管支鏡で留置可能です。
デメリット:感染、肉芽組織形成などの合併症が増え、留置4~6週間または気胸が改善した時点での回収が推奨され、高価となります
EWS(Endobronchial Watanabe Spigot)
メリット:3サイズから選択可能(大(7mm)、中(6mm)、小(5mm))、でさまざまな気管支径に対応可能で、標的気管支の迅速な瘻孔閉鎖が可能です。
デメリット:・安定性に乏しく、留置の手技が困難で、留置後の最大のリスクはとして逸脱があります。そのため、可能なかぎり末梢側に深く挿入し、鎮咳薬を併用することが推奨されています。